单细胞测序(scRNA-seq)对于制备的细胞悬液的细胞活性和细胞数目有着较高的要求,而且必须要求新鲜的样本,但是那些已经冻起来的样本库里面大量的珍贵样本,比如脑组织、心脏组织、肿瘤组织等都无法进行scRNA-seq,单细胞核转录组测序的出现极大的解决了这个问题。
单细胞核转录组测序(Single Nuclei RNA Sequencing,snRNA-seq):通过提取样本单细胞核,然后分离、标记细胞核,在单细胞水平研究核基因表达检测的技术。为脑组织、心脏、肾脏等复杂组织或一些珍稀冻存样品提供了单细胞水平研究应用平台,可挖掘更多潜在的致病细胞类型,更易于探讨肿瘤细胞异质性和致病机理。
那么scRNA-seq和snRNA-seq都什么时候用呢?它们各有什么优缺点呢?下面小编就为各位老师总结一下。
单细胞核测序(snRNA-seq)的应用
脑组织样本的snRNA-seq
对于脑组织来说, scRNA-seq并不能全面地分析神经细胞的类型。一些细胞类型更容易受到组织解离过程的影响,比如在成人的新大脑皮层中,非神经元细胞在解离中比神经元耐受性更好,在单细胞悬浮液中大量存在;在小鼠新皮层中,第5层parvalbuin阳性的间神经元和皮质下突起的谷氨酸能神经元的比例低于预期。相反,细胞核对机械处理更有抵抗力,可以从冷冻组织中解离出来。研究发现,单个细胞核已被证明可以提供足够的基因表达信息来定义成人大脑和小鼠海马区相对宽泛的细胞类别。此外,新鲜分离的神经组织很难获得;相比之下,从意外去世或者因疾病去世后病人处所获得的正常和疾病组织,是研究大脑组织中细胞类型的主要样本类型。但是,这些组织通常是冰冻的样本,因此snRNA-seq是解决细胞类型少以及冰冻样本的重要方法。
研究发现,从冷冻的S1皮层中分离单个核,进行神经核抗原(NeuN)流动分选,并在Fluidigm C1系统上进行RNA测序,细胞核和细胞数据显示检测到的基因数量和类型相似(S1细胞核-平均5619个基因;S1细胞-平均4797个基因)。核数核据含有较高比例的内含子reads。
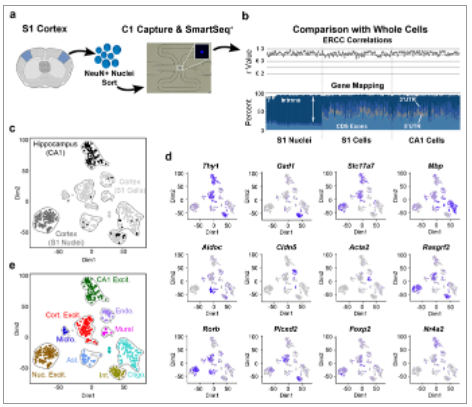
图. SnRNA-seq揭示了兴奋性神经元的特性
Grubman 等人通过对从去世后的阿尔茨海默氏症患者和年龄匹配的非疾病患者身上提取的内嗅皮层组织进行snRNA-seq,最终得到了13,214个细胞,每个细胞中位数检测到646个基因。UMAP显示,共鉴定到了小胶质细胞、星形胶质细胞、神经元、少突胶质祖细胞(OPCs),少突胶质细胞和内皮细胞。
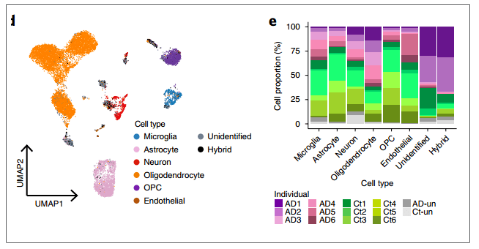
图. 人内嗅皮层snRNA-seq揭示阿尔茨海默病中细胞类型特异性标记基因和细胞类型特异性改变
同样是阿尔兹海默症疾病,Mathys等人通过对冷冻的去世后病人脑组织进行snRNA-seq,共鉴定到了人类大脑的主要细胞类型:兴奋性神经元(NRGN标记),抑制性神经元(GAD1),星形胶质细胞(AQP4),少突胶质细胞(MBP),小胶质细胞(CSF1R和CD74)、少突胶质祖细胞(VCAN)、内皮细胞和周细胞(AMBP)。
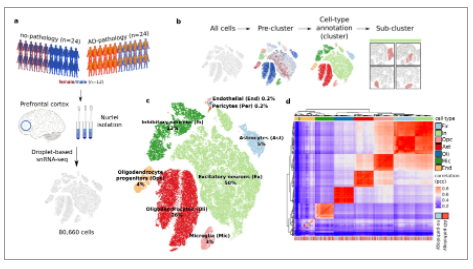
图. snRNA-seq谱分析阿尔兹海默症病人脑组织中细胞类型
心脏组织样本的snRNA-seq
在心脏的单细胞RNA测序研究中也存在着许多难点。首先,成年的心脏组织较难消化,很难保证在不损伤细胞的情况下,得到高质量的细胞悬液;再者,由于心肌细胞大,且形状不规则,导致细胞捕获较难。因此,心脏的研究通常依赖胚胎和新生儿的小鼠心脏或关注成年小鼠心脏的非心肌细胞群来避免这些问题。2020年发表的一篇关于哺乳动物心脏单细胞核RNA测序探索细胞成分和细胞特征的文章,则在一定程度上扫除了心脏单细胞RNA测序的障碍。snRNA-seq分析得到了8635个细胞核和22,568个基因,每个细胞平均得到2662.6 reads。UMAP显示了24个不同的细胞类群,,其中最多的是内皮细胞(28.8%)、成纤维细胞(25.3%)和心肌细胞(22.8%),它们分别含有约2500个、2200个和2000个细胞核。
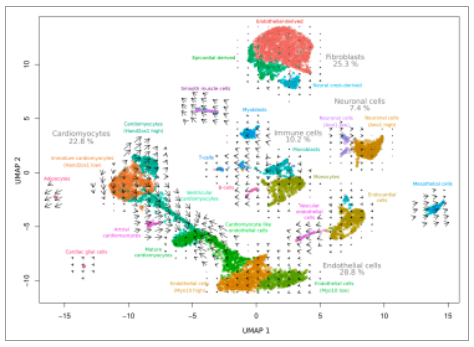
图. snRNA-seq谱分析心脏组织中细胞类型
Cui等人使用snRNA-seq揭示再生新生儿和非再生晚期心脏心肌细胞的不同群体。结果表明,一个明显的未成熟的心肌细胞群体进入细胞周期响应损伤。对这些心肌细胞的转录组分析揭示了支持新生儿再生反应的基因调控网络,该网络的缺失与再生阻断相一致。
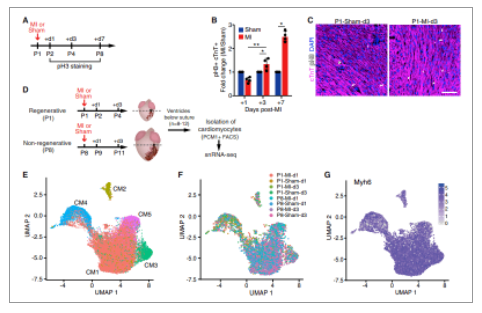
图. snRNA-seq 确定新生儿心脏中不同的心肌细胞群
肾脏组织样本的snRNA-seq
2019年,来自华盛顿大学医学院的Benjamin D. Humphreys团队比较分析了肾脏组织的单细胞RNA测序(scRNA-seq)和肾脏组织的单细胞核RNA测序(snRNA-seq)在肾脏细胞类群鉴定中的区别。与scRNA-seq相比, snRNA-seq捕获了多种在scRNA-seq数据集中不存在的肾脏细胞类型,包括肾小球足细胞、系膜细胞和内皮细胞。同时也未检测到应激反应基因。与已发表的scRNA-seq数据集(分别为2.4%和0.12%)相比, snRNA-seq方法产生了20倍以上的足细胞。
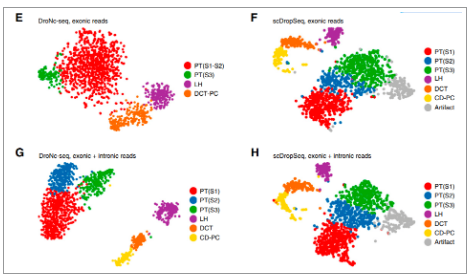
图. 加上内含子reads,snRNA测序的表现相当于或优于scRNA测序
Wilson等人通过对冷冻保存的糖尿病人肾脏样本进行snRNA-seq,共得到23,980单细胞核数据,其中包括11种肾脏细胞类型和4种免疫细胞类型(近曲小管;CFH,补体因子H阳性细胞;亨利循环细胞;远曲小管细胞;连接小管细胞;集尿管细胞;主细胞;插入细胞;阿足突细胞;内皮细胞;系膜细胞;白细胞)。
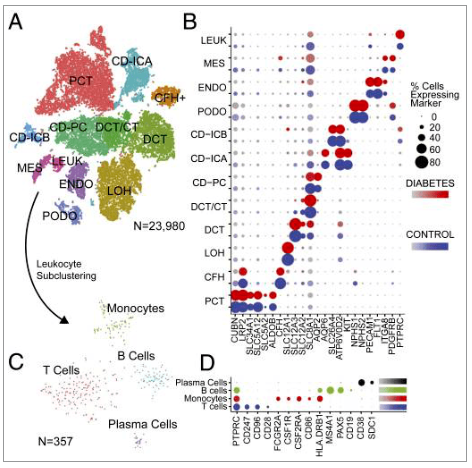
图. snRNA测序鉴定肾脏细胞及免疫细胞种类
单细胞测序(scRNA-seq)的缺点
一、仅适用于新鲜组织样本
悬液制备仅适用于新鲜组织样本,限制了单细胞测序技术的应用,很多具有重要科研和临床价值的冻存样本已经丧失活动,无法开展scRNA-seq。
二、某些细胞类型可能丢失,引发细胞类型的偏好
不易解离的细胞容易丢失,同时一些较为敏感的细胞可能会因为解离过度而破碎,比如:脑,心脏,肾脏,肝脏等,蛋白酶可能倾向于易于解离的细胞类型,不易解离的细胞类型容易丢失,或者敏感的细胞类型会破碎,会影响细胞类型的完整性。
例如脑组织无法通过常规的解离手段获得完好的细胞,因此这一组织中的细胞类型非常容易丢失。脑部的新生神经元(newborn neurons)也会遭遇同样的。
例如肾脏组织中的肾小球足细胞(glomerular podocytes), 肾小球系膜细胞(mesangial cells), 以及内皮细胞(endothelial cells)都无法通过scRNA-seq得到鉴别;肺脏组织如果通过scRNA-seq来鉴定细胞类型,会发现上皮细胞比例严重失真,而部分稀有细胞类型则无法得到鉴别。
三、悬液消化过程可能会导致应激基因的表达
解离过程可能会诱导应激基因的表达,引起细胞转录发生“人为改变”,造成“转录偏好(bias),这样可能会一定程度影响样本的真实情况。
四、特殊细胞情况:细胞较大、细胞形状不规则、细胞结团等情况
有些细胞类型,比如:心肌细胞、骨骼肌细胞和成熟的脂肪细胞,这些细胞都是直径比较大的细胞,是不能通过10x平台的微管道或者落入BD平台芯片的小孔的,如果研究的样本类型为心脏、脂肪等且关注心肌细胞、脂肪细胞信息,scRNA-seq就没有办法满足需求。
单细胞核测序(snRNA-seq)的优点
1、细胞核的获得比细胞悬液的获得简单
单细胞悬液制备过程往往是造成实验可变性的主要因素。如何获得足质足量的单细胞悬液,这是实验面临的第一个难题,特别是那些稀有细胞或难以解离的细胞;细胞核膜相比细胞膜更为坚固,因此,冻存组织细胞膜破裂后细胞核则能够保持完整,由于仅涉及机械破碎和简单的纯化,snRNA-seq操作步骤相对简化,便于开展实验,其稳定性相比scRNA-seq大大提高。
2、适用的样本类型扩大
单细胞核测序snRNA-seq由于是抽提细胞核进行测序,所以可以应用于冻存的样本,极大的利用了那些生理病理数据清晰的冻存样本;对于那些新鲜样本解离成功率低的样本;或者是样本的收集难度大,收集周期长,比如一个样本不同阶段的评估,或者根据治疗结果决定前端样本是否入组等情况;亦或是细胞体积大,形状不规则的样本都可以用snRNA-seq来解决。
3、降低人为引入的转录偏差
因为组织可以直接从冻存状态开始抽核,此状态下细胞转录活动已经被抑制并固定,因此不会再发生转录状态改变,结果真实性提高。
4、能够鉴定到的细胞类型更为全面和完整
直接对细胞进行机械法或者化学法破碎,不会引入的解离偏好性,理论上来讲所有细胞类型都能得到回收,能够获得更加完整和全面的细胞图谱。
单细胞核测序(snRNA-seq)的缺点
1、snRNA-seq会有检测到的基因偏少的风险
虽然有一些比较单细胞RNA测序(scRNA-seq)和单细胞核(snRNA-seq)测序的研究表明,转录本在整个细胞和细胞核中的表达程度相当;是理论上来讲,缺失了细胞质中的RNA分子,snRNA-seq在鉴定细胞转录状态中可能不如scRNA-seq,同时由于细胞核中带有polyA尾的成熟mRNA比例更低,因此对于某些样本而言,采用SnRNA-seq每个细胞核中检测到的基因可能会有偏少的风险,不利于细胞亚型的鉴定。
2、snRNA-seq对免疫细胞类型的获得不友好
虽然snRNA-seq能够获得更加全面完整的细胞类型,但是对于某些细胞类型的获得比例不如scRNA-seq,主要表现为免疫细胞。
 在线客服1号
在线客服1号




